MINI RECENSION
Utposten mot cancer: universella markörer endast för cancer
Chengchen Qian1, Xiaolong Zou2, Wei Li1,3, Yinshan Li4, Wenqiang Yu5
1Shanghai Epiprobe Biotechnology Co., Ltd, Shanghai 200233, Kina;2 Department of General Surgery, det första anslutna sjukhuset vid Harbin Medical University, Harbin 150001, Kina;3Shandong Epiprobe Medical Laboratory Co., Ltd, Heze 274108, Kina;4 People's Hospital i den autonoma regionen Ningxia Hui, Ningxia Medical University, Yinchuan 750002, Kina;5Shanghai Public Health Clinical Center & Department of General Surgery, Huashan Hospital & Cancer Metastasis Institute & Laboratory of RNA Epigenetics, Institutes of Biomedical Sciences, Shanghai Medical College, Fudan University, Shanghai 200032, Kina
ABSTRAKT
Cancer är den vanligaste dödsorsaken i världen.Tidig upptäckt av cancer kan sänka dödligheten för alla typer av cancer;emellertid saknas effektiva biomarkörer för tidig upptäckt för de flesta typer av cancer.DNA-metylering har alltid varit ett stort mål av intresse eftersom DNA-metylering vanligtvis sker före andra påvisbara genetiska förändringar.Medan man undersöker de gemensamma särdragen hos cancer med hjälp av en ny guidepositioneringssekvensering för DNA-metylering, har en serie universella markörer för endast cancer (UCOM) dykt upp som starka kandidater för effektiv och korrekt tidig upptäckt av cancer.Medan det kliniska värdet av nuvarande cancerbiomarkörer försämras av låg känslighet och/eller låg specificitet, säkerställer de unika egenskaperna hos UCOM kliniskt meningsfulla resultat.Validering av den kliniska potentialen för UCOMs i lungcancer, livmoderhalscancer, endometrie och urotelial cancer stöder ytterligare tillämpningen av UCOM i flera cancertyper och olika kliniska scenarier.I själva verket är tillämpningarna av UCOM för närvarande under aktiv utredning med ytterligare utvärdering i tidig upptäckt av cancer, hjälpdiagnos, behandlingseffektivitet och övervakning av återfall.De molekylära mekanismerna genom vilka UCOMs upptäcker cancer är nästa viktiga ämnen som ska undersökas.Tillämpningen av UCOM i verkliga scenarier kräver också implementering och förfining.
NYCKELORD
Cancer upptäckt;cancerscreening;DNA-metylering;cancer epigenetik;cancerbiomarkörer
Varför vi akut behöver nya biomarkörer?
Efter att ha bekämpat cancer i över ett sekel är cancer fortfarande det mest dödliga biologiska hotet mot mänskligheten.Cancer är fortfarande ett globalt hälsoproblem med 19,3 miljoner nya fall och nästan 10 miljoner dödsfall beräknade 20201. År 2020 uppskattningsvis 4,6 miljoner nya cancerfall diagnostiserades i Kina, vilket motsvarar 23,7 % av nya cancerfall globalt enligt GLOBOCAN1.Dessutom tillskrevs cirka 3 miljoner dödsfall till cancer i Kina 2020, vilket var 30 % av de globala cancerrelaterade dödsfallen1.Denna statistik visade att Kina rankas först i incidensen och dödligheten av cancer.Dessutom är 5-årsöverlevnaden för cancer 40,5 %, vilket är 1,5 gånger lägre än 5-årsöverlevnaden i USA2,3.Den jämförelsevis lägre överlevnaden och den högre dödligheten i Kina än i länder med högre mänskliga utvecklingsindex tyder på att ett effektivt och kostnadseffektivt cancerförebyggande och övervakningssystem är brådskande.Tidig upptäckt av cancer är en av de mest kritiska delarna i ett sjukvårdssystem.Tidig upptäckt av cancer kan förbättra prognosen och överlevnaden i ett tidigt skede i nästan alla cancertyper4.Framgångsrika screeningstrategier har lett till en betydande minskning av incidensen och dödligheten av livmoderhalscancer, bröstcancer, kolorektal och prostatacancer.
Att uppnå en tidig upptäckt av cancer är dock ingen lätt uppgift.Att undersöka biologin och prognosen för tidig cancer, att identifiera och validera tillförlitliga biomarkörer för tidig upptäckt och att utveckla tillgängliga och exakta tekniker för tidig upptäckt har alltid varit de största hindren i processen4.Exakt upptäckt av cancer kan skilja godartade från maligna lesioner, vilket hjälper till att undvika onödiga procedurer och underlättar ytterligare sjukdomshantering.Aktuella strategier för tidig upptäckt inkluderar endoskopbaserade biopsier, medicinsk bildbehandling, cytologi, immunanalyser och biomarkörtester5-7.Eftersom de är påträngande och kostsamma, bär endoskopbaserade biopsier på en tung börda som en stor medicinsk procedur som förlitar sig på professionell personal.Liksom cytologi är båda screeningmetoderna beroende av medicinsk personal och baseras på personligt omdöme med en prestation som är långt ifrån idealisk8.Däremot är immunanalyser mycket inexakta, med tanke på de höga falska positiva frekvenserna.Medicinsk avbildning, som en screeningtaktik, kräver dyr utrustning och specialiserade tekniker.Därför är medicinsk bildbehandling extremt begränsad på grund av den låga tillgängligheten.Av alla dessa skäl verkar biomarkörer vara ett bättre alternativ för tidig upptäckt av cancer.
Korrespondens till: Yinshan Li och Wenqiang Yu
Email: liyinshan@nxrmyy.com and wenqiangyu@fudan.edu.cn
ORCID ID: https://orcid.org/0009-0005-3340-6802 och
https://orcid.org/0000-0001-9920-1133
Mottaget 22 augusti 2023;godkänd 12 oktober 2023;
publicerad online 28 november 2023.
Tillgänglig på www.cancerbiomed.org
©2023 Cancerbiologi och medicin.Creative Commons
Attribution-NonCommercial 4.0 International License
Biomarkörer kategoriseras för närvarande som proteiner, DNA-mutationsmarkörer, epigenetiska markörer, kromosomavvikelser, RNA-markörer som härrör direkt från tumörer eller tumörfragment erhållna indirekt från kroppsvätskor.Proteinmarkörer är de mest använda biomarkörerna vid cancerscreening och diagnostik.Proteinbiomarkörer, som screeningbiomarkörer, begränsas av tendensen att påverkas av benigna lesioner, vilket leder till överdiagnostik och överbehandling, vilket har rapporterats för α-fetoprotein och prostataspecifikt antigen (PSA)9,10.RNA-markörer inkluderar genetiska uttrycksmönster och andra icke-kodande RNA-markörer. En kombination av genetiska expressions-RNA-markörer kan detekteras med hjälp av urinprover, vars känslighet var långt ifrån tillfredsställande (60 %) för primära tumörer, och detekteringen av dessa kan påverkas av den lätta nedbrytningen av RNA i den normala miljön11.Genetiska och epigenetiska markörer står båda inför problemet med prevalens i tumörer och begränsning till cancertyper.
DNA-metylering har varit en stark kandidat som biomarkör för tidig upptäckt sedan Feinberg först kopplade till cancer 198312. DNA-metyleringsavvikelser observeras i alla stadier av cancer, så tidigt som i det precancerösa stadiet.Avvikande DNA-hypermetylering sker vanligtvis på CpG-öar i genpromotorer för att motverka tumörsuppressorer13,14.Studier har också föreslagit att onormal DNA-hypermetylering engagerar sig i uppreglering av utvecklingsregulatorer15.DNA-metyleringsdalen, som vanligtvis är förknippad med utvecklingsregulatorer och hypermetylerade cancerformer, kan byta genuttrycksläge till ett mer stabilt DNA-metyleringsberoende läge och minska kopplingen till metylerad histon H3K27me3 och associerade polykamproteiner16,17.
Bland det stora antalet publicerade DNA-metyleringsmarkörer har flera framgångsrikt debuterat på marknaden;Men de nuvarande kommersialiserade DNA-metyleringsmarkörerna och diagnostiska panelerna har ännu inte helt låst upp potentialen för tidig upptäckt av cancer av flera skäl18.Även om de oftast visar acceptabel prestanda med hjälp av databasinformation, fungerar dessa biomarkörer vanligtvis mindre idealiskt i den verkliga världen på grund av det faktum att verkliga prover ofta är mer komplexa och inte lika representativa som de som valts ut i databaserna.Nästa generations sekvenseringsbaserad multi-cancermetylering tidig upptäckt har visat sig ha endast 16,8 % och 40,4 % känslighet i stadium I respektive II cancer19.Tidiga detektionstester kräver större stabilitet och mer exakta biomarkörer.
Universal cancer only markör (UCOM) upptäckt med hjälp av guidepositioneringssekvensering (GPS)
Trots årtionden av cancerforskning har tillfredsställande förebyggande och behandling inte uppnåtts.Det behövs nya metoder för att göra det möjligt för forskare att grundligt utvärdera cancer.Under de senaste 23 åren har 6 cancerkännetecken, såsom undvikande av apoptos, vävnadsinvasion och metastaser, etc., utökats till 14 genom att inkludera funktioner som icke-mutationell epigenetisk omprogrammering och polymorfa mikrobiomer20,21.I takt med att fler detaljer som rör cancer avslöjas, introduceras fler perspektiv på cancerforskningen.Cancerforskningen har gradvis kommit in i en nyare tid i två riktningar (gemenskap och individualitet).Med utvecklingen av precisionsonkologin under de senaste åren lutar cancerforskningens fokus mot individualiserad riktad terapi och cancerns heterogenitet22.Sålunda har nyligen identifierade cancerbiomarkörer främst fokuserat på specifika cancertyper, såsom PAX6 forcerad cancer23 och BMP3 för kolorektal cancer24.Prestandan för dessa biomarkörer som är specifika för cancertyper varierar, men det är fortfarande inte möjligt för känsliga individer att genomgå screening för alla cancerformer samtidigt på grund av begränsningen av biologisk provtagning och den höga kostnaden.Det skulle vara idealiskt om vi kunde identifiera en enda robust biomarkör som är effektiv för alla typer av cancer i ett tidigt stadium.
För att uppnå ett sådant idealiskt mål måste en bättre biomarkörkandidat väljas från listan över potentiella biomarkörtyper.DNA-metyleringsavvikelser, bland alla genetiska och epigenetiska profiler, är kända för att vara relaterade till cancer och är några av de tidigaste, om inte första, cancerrelaterade avvikelserna som inträffar kronologiskt.Utredningen av DNA-metylering startade tidigt, men har försvårats av bristen på forskningsmetoder.Bland 28 miljoner potentiella metylerade CpG-ställen i genomet måste ett hanterbart antal detekteras och anpassas till genomet för att bättre förstå tumörbildning.Helgenom-bisulfitsekvensering (WGBS), som anses vara guldstandarden för DNA-metyleringssekvensering, kan endast täcka 50 % av Cs i cancerceller på grund av arten av bisulfitbehandling som bryter DNA-fragment och sänker genomets komplexitet under omvandlingen av Cs-till-Ts25.Andra metoder, såsom 450k chips, täcker bara 1,6% av genomets metylering.Baserat på 450 000 data har en panel för detektion av DNA-metylering 35,4 % känslighet för 6 typer av cancer i stadium I26.Begränsningar av cancertyper, dålig prestanda och buller som genereras av detektionsmetoder i den analytiska processen har blivit de största hindren för pan-cancerdetektionspaneler.
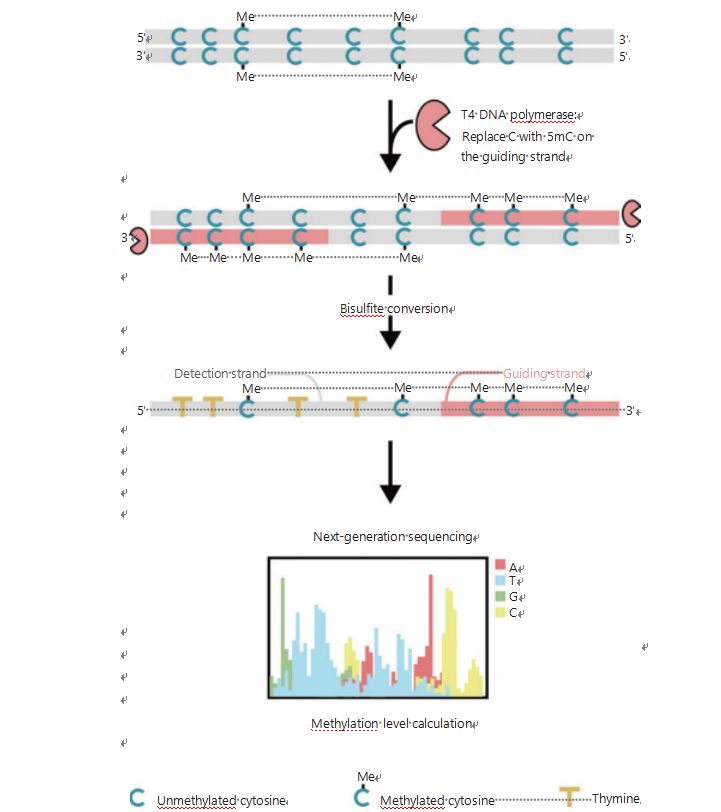
För att bättre undersöka de epigenetiska mönstren hos celler under tumörbildning och metastasering utvecklade vi en unik GPS för genomomfattande DNA-metyleringsdetektering, som täcker upp till 96 % av CpG-ställena i 0,4 miljarder läsningar25.GPS är en bilateral sekvenseringsmetod som använder ett 3′-ände av DNA-fragment av icke-konverterbara metylcytosiner efter bisulfitbehandling som styr anpassningen av DNA-metyleringsberäkningen av 5′-änden genom paränd-sekvensering (Figur 1)25.Den metyl-cytosin vägledande strängen, som fungerar som en mallsträng, hjälper till med hög GC-regionanpassning som återvinner de mest övergivna sekvenseringsdata i traditionell WGBS.Den höga täckningsfunktionen hos GPS ger en enorm mängd DNA-metyleringsinformation, vilket gör att vi kan undersöka cancermetyleringsprofiler med en betydligt högre upplösning i tidigare undersökta regioner.
GPS ger oss ett kraftfullt verktyg för att undersöka homogeniteten hos cancer, vilket avsevärt kan förenkla cancerforskningen och potentiellt hitta en universell förklaring till tumorigenes och metastaser.När man analyserade GPS-data från cancercellinjer stötte man ofta på ett unikt fenomen.Det fanns ett antal regioner som verkade vara onormalt hypermetylerade i flera typer av cancerprover.Detta oväntade fynd validerades sedan för att fungera som UCOM.Mer än 7 000 prover från 17 typer av cancer i databasen The Cancer Genome Atlas (TCGA) har analyserats, bland vilka vi identifierade den första UCOM, HIST1H4F, en histonrelaterad gen som är hypermetylerad i alla typer av cancer27.En serie UCOM:er hittades sedan och validerades i TCGA-databasen, Gene Expression Omnibus-databasen (GEO) och verkliga kliniska prover.Från och med nu har HIST1H4F, PCDHGB7 och SIX6 hittats och validerats som UCOM.Den oväntade upptäckten av UCOM erbjuder ett kraftfullt svar på behovet av tidig upptäckt av cancer.UCOM tillhandahåller en lösning för detektion av en enda markör av flera cancerformer.
Egenskaper för UCOM
Efter validering har UCOM:er visat sig uppvisa fyra huvudegenskaper som gör att UCOM:er kan överträffa effektiviteten hos nuvarande biomarkörer (Figur 2).
Unikt för malignitet
UCOM är unika för cancerösa eller pre-cancerösa lesioner och påverkas inte av normala fysiologiska förändringar.Några av de nuvarande cancerrelaterade markörerna som har använts i stor utsträckning vid tidig upptäckt och/eller screening har lett till överdiagnostik.Förhöjda PSA-nivåer, ett kliniskt ackrediterat screeningverktyg, upptäcks också vid benigna tillstånd, såsom prostatahyperplasi och prostatit10.Överdiagnostiken och den resulterande överbehandlingen leder till minskad livskvalitet på grund av tarm-, urin- och sexuella komplikationer28.Andra proteinbaserade och allmänt använda biomarkörer i den kliniska miljön, såsom CA-125, har inte gett några betydande fördelar samtidigt som de ådragit sig överdiagnostik och överbehandling29.Den höga specificiteten hos UCOM för maligniteter undviker dessa brister.UCOM, PCDHGB7, skiljer effektivt höggradiga skivepitelskador (HSIL) och livmoderhalscancer från normala prover och låggradiga skivepitelskador (LSIL), medan de flesta andra biomarkörer endast kan skilja livmoderhalscancer från normala prover30.Även om PCDHGB7 inte upptäcker signifikanta skillnader mellan normal endometrium och endometriehyperplasi, upptäcks signifikanta skillnader mellan normal endometrium och atypisk hyperplasi, och ännu större skillnader detekteras mellan normal endometrium och endometriecancer (EC) baserat på PCDHGB731.UCOM är unika för maligna lesioner i databaser och kliniska prover.Ur ett patients perspektiv minskar unika UCOM tröskeln för att förstå komplexa indikationer på olika dåligt presterande instabila biomarkörer och motsvarande oro under utvärderingsprocessen.Ur läkarens perspektiv skiljer unika UCOM:er maligniteter från benigna lesioner, vilket underlättar triage av patienter och minskar onödiga medicinska ingrepp och överbehandling.Därför minskar unika UCOM:s medicinska systemredundans, lindrar systemnöd och gör fler medicinska resurser tillgängliga för de behövande.
Figur 1 Schematisk GPS-arbetsflöde för DNA-metyleringsdetektering25.Grå linje: inmatad DNA-sekvens;röd linje: DNA behandlat med T4 DNA-polymeras, som ersätter cytosin med 5'-metylcytosin vid 3'-änden av inmatningen;blått C med Me: metylerat cytosin;blått C: ometylerat cytosin;gult T: tymin25.
Allt eller inget
UCOM finns bara i cancerceller och detekteras stabilt i nästan alla cancerceller.HIST1H4F validerades för att vara hypermetylerad i nästan alla tumörtyper men inte i normala prover27.På liknande sätt har PCDHGB7 och SIX6 också visat sig vara hypermetylerade i alla tumörprover men inte i normala prover30-32.Denna unika egenskap förbättrar avsevärt prestandan för UCOM med avseende på gränsen för detektion och känslighet.Så få som 2 % av cancercellerna kan differentieras i prover, vilket gör UCOM till en mycket känsligare biomarkör än de flesta befintliga biomarkörer30. Som en biomarkör som används för upptäckt av kolorektal cancer, existerar KRAS-mutationer endast i cirka 36 % av fallen av kolorektal cancer, tyder på dålig diagnostisk potential33.Den låga prevalensen av KRAS-mutationer i kolorektal cancer begränsar KRAS i kombination med andra biomarkörer.Faktum är att en kombination av biomarkörer kan verka lovande initialt, men genererar inte alltid ett tillfredsställande resultat samtidigt som det visar mycket större brus i detektionsanalys och involverar vanligtvis mer komplicerade experimentella procedurer.Däremot finns PCDHGB7 och andra UCOM i alla cancerformer.UCOMs upptäcker cancerkomponenter i olika typer av cancerprover med yttersta precision samtidigt som de eliminerar komplexa brusreducerande analysprocesser.Det är inte svårt att upptäcka cancer i ett rikligt prov, men det är extremt utmanande att upptäcka cancer i ett litet prov.UCOM kan upptäcka små mängder cancer.
Figur 2 Karakteristika för UCOM.
Cancerupptäckt före patologiska förändringar
UCOM kan detekteras i det pre-cancerösa stadiet före patologiska förändringar.Som epigenetiska biomarkörer inträffar UCOM-avvikelser i ett tidigare skede än fenotypiska avvikelser och är detekterbara genom hela tumörbildning, progression och metastaser34,35.Känsligheten hos UCOM över tid förbättrar UCOMs prestanda för att upptäcka cancer i tidigt stadium och pre-cancerösa lesioner.Att upptäcka tidig cancer baserat på biopsier och cytologi kan vara svårt även för de mest erfarna patologerna.En enstaka biopsi som erhållits via kolposkopi har rapporterats som positiv i 60,6 % av HSIL+-proverna.Ytterligare biopsier krävs för flera lesioner för att öka känsligheten36.Däremot har UCOM, PCDHGB7, en känslighet på 82 % för HSIL+-prover, vilket överträffar känsligheten för biopsier och de flesta biomarkörer30.Metyleringsmarkören, FAM19A4, har en känslighet på 69 % för CIN2+, vilket liknar cytologi, men kan inte skilja CIN1 från normala prover37.UCOM har visat sig vara en mycket känsligare biomarkör för tidig upptäckt.Jämfört med erfarenhetsbaserade patologer har UCOM överlägsen detektionskänslighet för cancer i tidiga skeden, vilket i sin tur bidrar till förbättrad cancerprognos och överlevnad30.Dessutom erbjuder UCOM en detektionsplattform som är tillgänglig för områden som saknar erfarna patologer och avsevärt förbättrar detektionseffektiviteten.Med enhetliga provtagnings- och detektionsprocedurer ger UCOM-detektering stabila och lätttolkade resultat som bättre passar ett screeningprotokoll som kräver mindre professionell personal och medicinska resurser.
Lätt att upptäcka
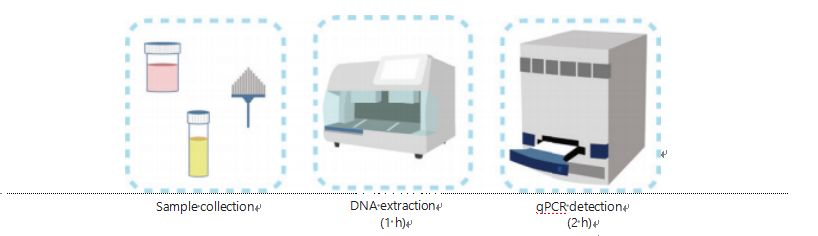
Nuvarande metoder för DNA-metyleringsdetektion är komplicerade och tidskrävande.De flesta av metoderna kräver bisulfitomvandling, vilket orsakar en förlust av provkvalitet och eventuellt ger instabila och felaktiga resultat.Den dåliga reproducerbarheten som orsakas av bisulfitbehandling leder potentiellt till förvirring för läkare och patienter och stör ytterligare uppföljnings- och/eller behandlingsstrategier.Därför modifierade vi ytterligare metoden för UCOM-detektion för att undvika problematisk bisulfitbehandling av proverna, tillgodose de kliniska tillämpningskraven och förbättra tillgängligheten.Vi utvecklade en ny metod med användning av metyleringskänsliga restriktionsenzymer kombinerat med realtidsfluorescerande kvantitativ PCR (Me-qPCR) för att kvantifiera metyleringsstatusen för UCOM inom 3 timmar med enkla hanteringsprocedurer (Figur 3).Me-qPCR kan ta emot flera provtyper, såsom klinisk insamling av kroppsvätskor och självinsamlade urinprover.Insamlade kliniska prover kan bearbetas, lagras och enkelt fortsätta till upptäckt med standardiserad och automatiserad DNA-extraktion.Det extraherade DNA:t kan sedan appliceras direkt på Me-qPCR-plattformen för en enkärlsreaktion och resultatkvantifieringsresultat.Efter enkel resultatanalys med hjälp av diagnostiska modeller anpassade och validerade för specifika cancertyper, tolkas och presenteras den slutliga bestämningen av UCOM-detekteringsresultat som ett semikvantitativt värde.Me-qPCR-plattformen överträffar den traditionella bisulfit-pyrosekvenseringen i UCOM-detektion samtidigt som den sparar 3 timmars bisulfitkonvertering, enligt EZ DNA Methylation-Gold kit-protokollet.Den innovativa plattformen för metyleringsdetektering gör UCOM-detektion stabilare, mer exakt och mer tillgänglig30.
Figur 3 Detektionsprocess för UCOM.Provtyper inkluderar professionellt provtagen BALF, Pap-borste och/eller självuppsamlad urin.DNA-extraktionsprocessen kan anpassas till en automatisk extraktor, vars produkt kan detekteras direkt med qPCR.
Tillämpning av UCOM
Lungcancer
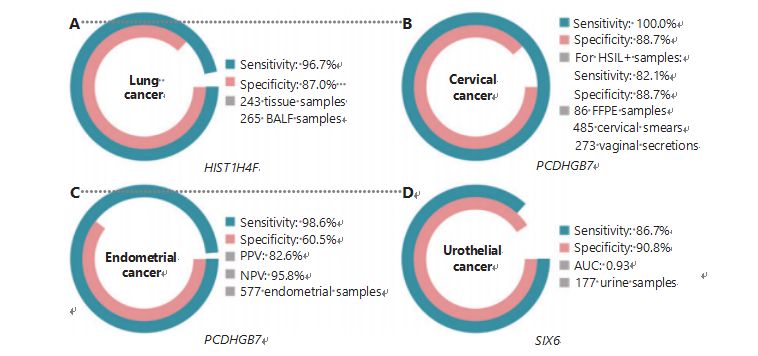
Lungcancer är den näst vanligaste och mest dödliga cancern i världen, och står för 11,4 % av nya fall och 18,0 % av nya dödsfall1.Bland alla diagnoser är 85 % icke-småcellig lungcancer (NSCLC) och 15 % är småcellig lungcancer (SCLC), som har en högre nivå av malignitet38.Lågdosdatortomografi (LDCT)-skanning är den för närvarande rekommenderade screeningmetoden för lungcancer och har visat sig förbättra tidig upptäckt och minska dödligheten6;Men på grund av låg specificitet och dålig tillgänglighet har LDCT ännu inte fungerat som en tillfredsställande screeningsmetod, liksom andra vanliga cancermarkörer, såsom CEA39.Kostnaderna och potentialen för missade diagnoser och felaktiga diagnoser av LDCT-screeningsstrategin hindrar framstegen i främjandet av lungcancerscreening40.HIST1H4F, en UCOM, har enorm potential som biomarkör för tidig upptäckt i bronkoalveolär vätska (BALF) prover27.HIST1H4F är hypermetylerad i lungadenokarcinom och lungskivepitelcancer, med en detektionsspecificitet på 96,7 % och sensitivitet på 87,0 % (Figur 4A), och en exceptionell prestanda för cancer i stadium I27.HIST1H4F har en specificitet på 96,5 % och en sensitivitet på 85,4 % för NSCLC och 96,5 % respektive 95,7 % för SCLC27.Dessutom har prover av åtta andra typer av cancer, inklusive pankreascancer och kolorektal cancer, validerat att HIST1H4F är hypermetylerad i alla åtta typer27.
Livmoderhalscancer
Livmoderhalscancer var den fjärde vanligaste cancersjukdomen och den fjärde vanligaste orsaken till cancerdödsfall hos kvinnor 2020, och stod för 3,1 % av nya fall och 3,4 % av cancerrelaterade dödsfall globalt1.För att eliminera livmoderhalscancer till 2030, som WHO föreslår, är tidig upptäckt av livmoderhalscancer en nödvändighet.Om det upptäcks i ett tidigt skede når 5-årsöverlevnaden 92 % med invasiv livmoderhalscancer41.Riktlinjerna från American Cancer Society (ACS) föreslår cervikala cytologitester, primära HPV-tester eller samtest för screening42.Cervikal cytologi är invasiv och kan endast detektera 63,5 % av CIN2+ fall37.
PCDHGB7 har däremot presterat mycket bättre med cellprov och vaginala sekret, och kan effektivt skilja HSIL från LSIL i ett ultratidigt skede.Enbart PCDHGB7 har en sensitivitet på 100,0 % och en specificitet på 88,7 % för livmoderhalscancer (Figur 4B) och en sensitivitet på 82,1 % och 88,7 % specificitet för HSIL+-prover30.PCDHGB7 har också en 90,9 % sensitivitet och 90,4 % specificitet i vaginalt sekretprover för livmoderhalscancer, som är mycket lättare att samla in30.I kombination med högrisk (hr) HPV-testet eller Thinprep Cytology Test (TCT), har PCDHGB7 en ökad sensitivitet på 95,7 % och specificitet på 96,2 %, vilket avsevärt överträffar hrHPV-testet (20,3 %), TCT (51,2 %) ), och de två kombinerade (57,8 %) för livmoderhalscancer30.PCDHGB7 har också visat sig vara hypermetylerad i 17 typer av cancer från TCGA-databasen, vilket indikerar dess lämplighet i UCOM-familjen30.
Figur 4 UCOM har validerats i fyra typer av cancer i storskaliga kliniska studier.A. Prestanda för HIST1H4F, en UCOM, vid lungcancerdetektering av 508 prover.B. Prestanda för PCDHGB7, en UCOM, vid upptäckt av livmoderhalscancer av 844 prover.C. Prestanda för PCDHGB7, en UCOM, vid upptäckt av endometriecancer av 577 endometrie Pap och Tao borstprover.D. Prestanda för SIX6, en UCOM, i urotelial cancerdetektion av 177 prover.
EC
EC är en av de vanligaste cancersjukdomarna i det kvinnliga reproduktionssystemet i världen, med uppskattningsvis 4,2 miljoner nya fall och 1 % av cancerrelaterade dödsfall årligen1.Med en framgångsrik diagnos i ett tidigt stadium är EC botbar och har en 5-års överlevnadsgrad på 95 % för stadium I cancer.Patienter som är symtomatiska, såsom onormal livmoderblödning, får periodisk klinisk utvärdering och genomgår invasiva och smärtsamma biopsiprocedurer, trots att endast 5–10 % så småningom utvecklar EC43.Transvaginalt ultraljud, som den vanliga detektionsmetoden, är mycket opålitlig på grund av dess oförmåga att skilja benigna från maligna endometriella förändringar och den höga frekvensen av falskt positiva44.
En parallell jämförelse av serum CA-125, en allmänt implementerad EC-biomarkör, och PCDHGB7 genomfördes.Serum CA-125 hade en sensitivitet på 24,8 %, vilket tyder på att CA-125 är en otillräcklig markör för EC trots en specificitet på 92,3 %31.PCDHGB7-detektering med hjälp av Pap-borsteprover gav en sensitivitet på 80,65 % och en specificitet på 82,81 % för ECatall-stadier, medan en Tao-borste hade en sensitivitet på 61,29 % och en specificitet på 95,31 %31.Den diagnostiska modellen PCDHGB7, baserad på Me-qPCR, gav en sensitivitet på 98,61 %, en specificitet på 60,5 % och en total noggrannhet på 85,5 %, med hjälp av Pap- och Tao-borsteprover (Figur 4C)31.
Urothelial cancer
Urothelial cancer, bestående av cancer i urinblåsan, njurbäckenet och urinledaren, var den sjunde vanligaste cancerformen 2020 i världen och orsakade 5,2 % av nya fall och 3,9 % av dödsfallen1.Urothelial cancer, varav mer än 50 % är cancer i urinblåsan, var den fjärde mest frekvent diagnostiserade cancern i USA 2022, och stod för 11,6 % av de nydiagnostiserade fallen3.Ungefär 75 % av cancer i urinblåsan klassificeras som icke-muskelinvasiv blåscancer begränsad till slemhinnan eller submucosa45.En cystoskopibiopsi är guldstandarden för att diagnostisera urotelial cancer implementerad genom fluorescens in situ hybridisering (FISH) och cytologitester.FISH och cytologi har dålig diagnostisk prestanda, och cystoskopi är påträngande och har den underliggande risken att missa mikrolesioner, feltolka lesioner och potentiellt orsaka spridning eller återfall av cancer46.Den tidigare validerade UCOM, PCDHGB7, visades också vara hypermetylerad vid urotelial cancer, med en yta under kurvan på 0,86, vilket tyder på en potentiell diagnostisk förmåga30.För att ytterligare validera fler UCOM och bättre tillgodose fler provtyper undersöktes SIX6, en ny UCOM, och visade utmärkt diagnostisk potential vid tidig upptäckt av urotelcancer med hjälp av urinprover på Me-qPCR-plattformen.SIX6-detektion med urinprov visade en konkurrenskänslighet på 86,7 % och en specificitet på 90,8 % (Figur 4D), samtidigt som den var icke-invasiv och lätt att förvärva32.Potentialen för SIX6 vid metastasövervakning och utvärdering av behandlingseffekt är för närvarande under utredning.
Framtiden och utmaningarna
UCOM har en stark prestation i den diagnostiska potentialen för flera cancerformer, men det finns mycket arbete kvar att göra.Vi har utökat listan över UCOM och har aktivt validerat UCOM i fler typer av cancer, inklusive de som traditionellt är svåra att upptäcka.Valideringsresultat från TCGA-databaser har ytterligare bekräftat tillämpningen av UCOM i fler typer av cancer och fler situationer.I en preliminär undersökning har UCOM visat sig ha en robust diagnostisk potential för kolangiokarcinom och pankreasadenokarcinom, vilka är nästan omöjliga att diagnostisera i ett tidigt stadium med nuvarande screeningmetoder32,47.Förmågan att upptäcka sällsynta cancerformer med UCOM kan utnyttjas med cirkulerande tumör-DNA (ctDNA) av en förbättrad flytande biopsiplattform48.En studie som involverade en plasma-DNA-baserad pan-cancer-detektionspanel gav en känslighet på 57,9 %49.Trots den höga specificiteten avslöjar den övergripande prestandan att det fortfarande finns utrymme för förbättringar.
De unika egenskaperna hos UCOM har också stött undersökningen av UCOM-potential vid utvärdering av behandlingseffekt och övervakning av återfall.Enligt Response Evaluation Criteria in Solid Tumors (RECIST) är medicinsk avbildning den rekommenderade metoden för övervakning av återfall och utvärdering av behandlingseffekt, medan tumörmarkörer används ensamma för bedömning50.I verkligheten påverkas dock avbildningsmetoder i hög grad av frekvensen och tajmingen och utsätter därför patienterna för högre risk och kostnader51,52.SIX6 har validerats för att fungera som en prediktor för bröstcancermetastaser32.Flytande biopsibaserad ctDNA-övervakning möjliggör övervakning i realtid över minimala kvarvarande sjukdomsmånader före radiologisk upptäckt, vilket idealiskt försenar och förhindrar återfallsrelaterad cancerprogression53.Preliminära resultat tyder på att UCOM återspeglar nivån av cancerös hypermetylering i realtid direkt efter operation och behandling32.Den höga känsligheten som UCOM uppvisar och tillämpbarheten i flera icke-påträngande provtyper gör att UCOM kan fungera som en exakt biomarkör för återfallsövervakning samtidigt som hög patientföljsamhet bibehålls.
Samtidigt är allmänhetens tillgänglighet till testet en annan viktig fråga som kräver ytterligare ansträngningar.Medan UCOM-detekteringssamarbeten har antagits på fler sjukhus i hopp om att gynna fler patienter, har pro bono-detektioner och screeningar aktivt utförts på landsbygden i Kina.UCOM kräver förbättrad tillgänglighet för att kvalificera sig som ett genomförbart screeningverktyg, särskilt för underutvecklade områden.
Medan UCOM-applikationens resultat i tidig upptäckt är lovande, finns många okända om UCOM.Med aktiv utforskning är ytterligare forskning motiverad om varför UCOM är allmänt närvarande i cancer.De underliggande epigenetiska regleringsmekanismerna bakom UCOM är värda att undersökas ytterligare, vilket kan motivera en ny riktning för cancerterapi.För att återgå till samspelet mellan tumörhomogenitet och heterogenitet, är vi intresserade av varför UCOM kan vara ett undantag från majoriteten av cancerbiomarkörer som är nära kopplade till specifika cancertyper.Rollen av UCOM-identifierade DNA-metyleringsavvikelser i tumörbildning, tumörprogression och metastasering har inte fastställts i processen att förlora och återfå cellidentitet och kräver en grundlig inspektion.Ett annat stort intresse ligger i omfattningen av inkorporeringen av homogenitetsegenskapen hos UCOM med vävnadsunika markörer i hopp om att närma sig exakt detektion av cancerspår och identifiering av tumörvävnadsursprung på ett omvänt sätt.UCOM kan vara ett idealiskt verktyg för att förebygga cancer, upptäcka cancer och potentiellt försvara och eliminera cancer.
Bevilja stöd
Detta arbete stöddes av Kinas nationella nyckel-FoU-program (bidrag nr 2022BEG01003), Kinas nationella naturvetenskapsstiftelse (anslag nr 32270645 och 32000505), ett anslag från Heilongjiang Provincial Health Commission (bidrag nr 2020-111) , och ett anslag från Heze Science and Technology Institute (anslag nr 2021KJPT07).
Uttalande av intressekonflikt
Wei Li är FoU-direktör för Shanghai Epiprobe Biotechnology Co., Ltd. Wenqiang Yu sitter i Epiprobes Scientific Advisory Board.W. Yu och Epiprobe har godkänt väntande patent relaterade till detta arbete.Alla andra författare deklarerar inga konkurrerande intressen.
Författarbidrag
Tänkte och designade projektet: Chengchen Qian och Wenqiang Yu.
Skrev tidningen: Chengchen Qian.
Gjorde illustrationerna: Chengchen Qian.
Granskade och redigerade manuskriptet: Xiaolong Zou, Wei Li, Yinshan Li och Wenqiang Yu.
Referenser
1. Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, et al.Global Cancer Statistics 2020: GLOBOCAN uppskattningar av
incidens och dödlighet över hela världen för 36 cancerformer i 185 länder.CA Cancer J Clin.2021;71: 209-49.
2. Xia C, Dong X, Li H, Cao M, Sun D, He S, et al.Cancerstatistik i Kina och USA, 2022: profiler, trender och bestämningsfaktorer.Chin MedJ (eng.2022;135: 584-90.
3. Siegel RL, Miller KD, WagleNS, JemalA.Cancerstatistik, 2023. CA Cancer J Clin.2023;73: 17-48.
4. Crosby D, BhatiaS, Brindle KM, Coussens LM, Dive C, Emberton M, et al.Tidig upptäckt av cancer.Vetenskap.2022;375: eaay9040.
5. Ladabaum U, Dominitz JA, KahiC, Schoen RE.Strategier för
kolorektal cancerscreening.Gastroenterologi.2020;158: 418-32.
6. Tanoue LT, Tanner NT, Gould MK, Silvestri GA.Lungcancerscreening.Am J Respir Crit Care Med.2015;191: 19-33.
7. Bouvard V, Wentzensen N, Mackie A, Berkhof J, Brotherton J, Giorgi-Rossi P, et al.IARC:s perspektiv på screening av livmoderhalscancer.N EnglJ Med.2021;385: 1908-18.
8. Xue P, Ng MTA, QiaoY.Utmaningarna med kolposkopi för screening av livmoderhalscancer i LMIC och lösningar med artificiell intelligens.BMC Med.2020;18:169.
9. Johnson P, Zhou Q, Dao DY, Lo YMD.Cirkulerande biomarkörer vid diagnos och hantering av hepatocellulärt karcinom.Nat Rev Gastroenterol Hepatol.2022;19: 670-81.
10. Van PoppelH, Albreht T, Basu P, HogenhoutR, CollenS, Roobol M. Serum PSA-baserad tidig upptäckt av prostatacancer i Europa och globalt: dåtid, nutid och framtid.Nat Rev Urol.2022;19:
562-72.
11. HolyoakeA, O'Sullivan P, Pollock R, Best T, Watanabe J, KajitaY,
et al.Utveckling av ett multiplex RNA-urintest för detektion och stratifiering av övergångscellkarcinom i urinblåsan.Clin Cancer Res.2008;14: 742-9.
12. Feinberg AP, Vogelstein B. Hypometylering skiljer gener från vissa humana cancerformer från deras normala motsvarigheter.Natur.1983;301: 89-92.
13. Ng JM, Yu J. Promotorhypermetylering av tumörsuppressorgener som potentiella biomarkörer vid kolorektal cancer.IntJ Mol Sci.2015;16: 2472-96.
14. Esteller M. Cancerepigenomik: DNA-metylomer och histonmodifieringskartor.Nat Rev Genet.2007;8: 286-98.
15. Nishiyama A, Nakanishi M. Navigera i cancerns DNA-metyleringslandskap.Trender Genet.2021;37: 1012-27.
16. Xie W, Schultz MD, ListerR, Hou Z, Rajagopal N, Ray P, et al.Epigenomisk analys av multilineage differentiering av mänskliga embryonala stamceller.Cell.2013;153: 1134-48.
17. Li Y, Zheng H, Wang Q, Zhou C, WeiL, Liu X, et al.Genomomfattande analyser avslöjar Polycombs roll för att främja hypometylering av DNA-metyleringsdalar.Genome Biol.2018;19:18.
18. Koch A, JoostenSC, Feng Z, de Ruijter TC, DrahtMX, MelotteV,
et al.Analys av DNA-metylering i cancer: plats återbesökt.Nat Rev Clin Oncol.2018;15: 459-66.
19. KleinEA, Richards D, Cohn A, TummalaM, Lapham R, Cosgrove D, et al.Klinisk validering av ett målinriktat metyleringsbaserat test för tidig upptäckt av flera cancerformer med hjälp av en oberoende valideringsuppsättning.Ann Oncol.2021;32: 1167-77.
20. Hanahan D, Weinberg RA.Cancers kännetecken.Cell.2000;100: 57-70.
21. Hanahan D. Cancers kännetecken: nya dimensioner.Cancer Discov.2022;12:31-46.
22. Schwartzberg L, Kim ES, Liu D, Schrag D. Precisionsonkologi: vem, hur, vad, när och när inte?Am Soc Clin Oncol Educ-bok.2017: 160-9.
23. Liu H, Meng X, Wang J. Kvantitativ metylering i realtid
upptäckt av PAX1-genen vid screening av livmoderhalscancer.IntJ Gynecol Cancer.2020;30: 1488-92.
24. Imperiale TF, RansohoffDF, Itzkowitz SH, Levin TR, Lavin P, Lidgard GP, et al.Multitarget-pall DNA-testning för screening av kolorektal cancer.N EnglJ Med.2014;370: 1287-97.
25. Li J, Li Y, Li W, Luo H, Xi Y, Dong S, et al.Styrpositionering
sekvensering identifierar avvikande DNA-metyleringsmönster som förändrar cellidentitet och tumör-immunövervakningsnätverk.Genom
Res.2019;29: 270-80.
26. Gao Q, LinYP, Li BS, Wang GQ, Dong LQ, Shen BY, et al.Påträngande multi-cancerdetektion genom cirkulerande cellfri DNA-metyleringssekvensering (THUNDER): utveckling och oberoende valideringsstudier.Ann Oncol.2023;34: 486-95.
27. Dong S, Li W, Wang L, Hu J, Song Y, Zhang B, et al.Histonrelaterade gener hypermetyleras vid lungcancer och hypermetyleras
HIST1H4F kan fungera som biomarkör för pancancer.Cancer Res.2019;79: 6101-12.
28. Heijnsdijk EA, Wever EM, Auvinen A, Hugosson J, Ciatto S, Nelen V, et al.Livskvalitetseffekter av prostataspecifik antigenscreening.N EnglJ Med.2012;367: 595-605.
29. LuzakA, Schnell-Inderst P, Bühn S, Mayer-Zitarosa A, Siebert U. Klinisk effektivitet av biomarkörtester för cancerscreening som erbjuds som självbetalande hälsovård: en systematisk översyn.Eur J Folkhälsa.2016;26: 498-505.
30. Dong S, Lu Q, Xu P, Chen L, Duan X, Mao Z, et al.
Hypermetylerad PCDHGB7 som en universell markör för endast cancer och dess tillämpning vid tidig screening av livmoderhalscancer.Clin Transl Med.2021;11: e457.
31. Yuan J, Mao Z, Lu Q, Xu P, Wang C, Xu X, et al.Hypermetylerad PCDHGB7 som en biomarkör för tidig upptäckt av endometriecancer i endometrieborsteprover och livmoderhalsskrapningar.Front Mol Biosci.2022;8: 774215.
32. Dong S, Yang Z, Xu P, Zheng W, Zhang B, Fu F, et al.Ömsesidigt
exklusiv epigenetisk modifiering på SIX6 med hypermetylering för spårning av precancerösstadium och metastasuppkomst.Signal Transduct Target Ther.2022;7:208.
33. Huang L, Guo Z, Wang F, Fu L. KRAS-mutation: från odrogbar till drogbar vid cancer.Signal Transduct Target Ther.2021;6:386.
34. Belinsky SA, Nikula KJ, PalmisanoWA, MichelsR, SaccomannoG, GabrielsonE, et al.Avvikande metylering av p16(INK4a) är en tidig händelse i lungcancer och en potentiell biomarkör för tidig diagnos.Proc Natl Acad Sci U SA.1998;95: 11891-6.
35. Robertson KD.DNA-metylering och mänskliga sjukdomar.Nat Rev Genet.2005;6: 597-610.
36. WentzensenN, Walker JL, Gold MA, Smith KM, ZunaRE,
Mathews C, et al.Flera biopsier och detektion av livmoderhalscancerprekursorer vid kolposkopi.J Clin Oncol.2015;33: 83-9.
37. De Strooper LM, Meijer CJ, Berkhof J, Hesselink AT, Snijders
PJ, Steenbergen RD, et al.Metyleringsanalys av FAM19A4
genen i livmoderhalsskrap är mycket effektiv för att upptäcka livmoderhalsen
karcinom och avancerade CIN2/3 lesioner.Cancer Föregående Res (Phila).2014;7: 1251-7.
38. Thai AA, Solomon BJ, Sequist LV, Gainor JF, Heist RS.Lungcancer.Lansett.2021;398: 535-54.
39. Grunnet M, Sorensen JB.Carcinoembryonalt antigen (CEA) som tumörmarkör vid lungcancer.Lungcancer.2012;76: 138-43.
40. Wood DE, KazerooniEA, Baum SL, EapenGA, EttingerDS, Hou L, et al.Lungcancerscreening, version 3.2018, NCCN Clinical Practice Guidelines in Oncology.J Natl Compr Canc Netw.2018;16: 412-41.
41. American Cancer Society.Cancer fakta & siffror.Atlanta, GA, USA: American Cancer Society;2023 [uppdaterad 2023 1 mars;citerad 2023 22 augusti].
42. FonthamETH, Wolf AMD, Church TR, EtzioniR, Flowers CR,
Herzig A, et al.Livmoderhalscancerscreening för individer med genomsnittlig risk: 2020-riktlinjeuppdatering från American Cancer Society.CA Cancer J Clin.2020;70: 321-46.
43. Clarke MA, Long BJ, Del Mar MorilloA, Arbyn M, Bakkum-Gamez JN, Wentzensen N. Association of endometrial cancer risk with postmenopausal blödning hos kvinnor: en systematisk översikt och metaanalys.JAMA Intern Med.2018;178: 1210-22.
44. Jacobs I, Gentry-MaharajA, Burnell M, ManchandaR, Singh N,
Sharma A, et al.Känslighet vid transvaginal ultraljudsscreening
för endometriecancer hos postmenopausala kvinnor: en fallkontrollstudie inom UKCTOCS-kohorten.Lancet Oncol.2011;12:38-48.
45. BabjukM, Burger M, CompératEM, Gontero P, MostafidAH,
PalouJ, et al.European Association of Urology Guidelines on non-muskel-invasive blåscancer (TaT1 och Carcinoma In Situ) -
Uppdatering 2019.Eur Urol.2019;76: 639-57.
46. Aragon-Ching JB.Utmaningar och framsteg inom diagnos, biologi och behandling av uroteliala övre kanaler och urinblåsa karcinom.Urol Oncol.2017;35: 462-4.
47. Rizvi S, KhanSA, Hallemeier CL, Kelley RK, Gores GJ.
Cholangiocarcinoma – utvecklande koncept och terapeutiska strategier.Nat Rev Clin Oncol.2018;15: 95-111.
48. Ye Q, Ling S, Zheng S, Xu X. Vätskebiopsi i hepatocellulär
karcinom: cirkulerande tumörceller och cirkulerande tumör-DNA.Mol Cancer.2019;18:114.
49. Zhang Y, Yao Y, Xu Y, Li L, Gong Y, Zhang K, et al.Pan-cancer
cirkulerande tumör-DNA-detektion hos över 10 000 kinesiska patienter.Nat Commun.2021;12:11.
50. Eisenhauer EA, Therasse P, Bogaerts J, Schwartz LH, Sargent D, Ford R, et al.Nya svarsutvärderingskriterier i solida tumörer: reviderad RECIST-riktlinje (version 1.1).Eur J Cancer.2009;45: 228-47.
51. LitièreS, Collette S, de Vries EG, Seymour L, BogaertsJ.RECIST - lära av det förflutna för att bygga framtiden.Nat Rev Clin Oncol.
2017;14: 187-92.
52. Seymour L, Bogaerts J, Perrone A, FordR, Schwartz LH, Mandrekar S, et al.iRECIST: riktlinjer för svarskriterier för användning i försök
testa immunterapi.Lancet Oncol.2017;18: e143-52.
53. PantelK, Alix-Panabières C. Vätskebiopsi och minimal kvarvarande sjukdom – senaste framstegen och konsekvenser för botemedel.Nat Rev Clin Oncol.2019;16: 409-24.
Citera den här artikeln som: Qian C, Zou X, Li W, Li Y, Yu W. Utposten mot cancer: universella markörer endast för cancer.Cancer Biol Med.2023;20: 806-815.
doi: 10.20892/j.issn.2095-3941.2023.0313
Posttid: maj-07-2024